Что такое электродный потенциал?
Что такое электродный потенциал
Потенциал электрода или электродный потенциал металла — это разность потенциалов, которая возникает на границе раздела фаз металл-раствор при погружении металла в раствор электролита в результате взаимодействия поверхностных ион-атомов металла, находящихся в узлах кристаллической решетки, с полярными молекулами воды, ориентированными у поверхности электрода. Это связано с образованием двойного электрического слоя, то есть несимметричного распределения заряженных частиц у границы раздела фаз.

Явления растворения металлов в электролитах используются в химических источниках электроэнергии. Металлическая пластина, опушенная в раствор своей же соли, в той или иной мере стремится в ней раствориться. Это стремление иногда называется упругостью растворения металла.
Цинковая пластина, опущенная в раствор сернокислого цинка Zn SO4 , отдает в раствор частицы цинка в виде положительно заряженных ионов. Вследствие того, что атомы пинка уходят в виде положительно заряженных ионов, на цинковой пластине образуется избыток свободных электронов и она заряжается отрицательно, а в слое жидкости вблизи поверхности цинка образуется избыток положительных ионов и, следовательно, этот слой заряжается положительно. Таким путем на границе жидкости и металла возникает двойной электрический слой из пространственно разделенных зарядов противоположного знака.
Эти заряды будут противодействовать дальнейшему переходу металла в раствор — отрицательные пластины удерживают положительный ион металла, а положительный заряд электролита отталкивает ион металла назад на пластину. Иными словами, электрическое поле двойного слоя на границе металл — жидкость противодействует дальнейшему переходу ионов металла в раствор. Устанавливается равновесие между химическими по своей природе силами стремления металла перейти в раствор и электрическими силами, им противодействующими.
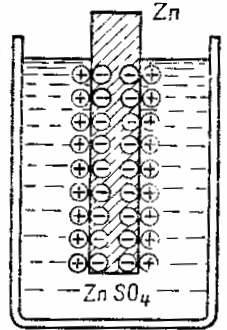
Схема образования двойного электрического слоя на границе металла и электролита
Таким образом, вследствие растворения в электролите металлический электрод приобретает по отношению к электролиту определенный электродный (иначе электрохимический) потенциал, зависящий от материала электрода и состава электролита.
Однако электродные потенциалы могут иметь положительное значение. Это имеет место в тех случаях, когда положительные ионы раствора переходят на электрод, заряжая его положительно, а слой электролита — отрицательно, например, когда медная пластина погружена в достаточно концентрированный раствор сернокислой меди (CuSO4).
Двойной электрический слой можно уподобить конденсатору, одна из обкладок которого представляет собой поверхность металла, а другая — слой ионов в растворе у поверхности металла. Между разноименно заряженными обкладками и возникает разность, или скачок, потенциала.
Скачок потенциала на границе электрод-раствор может служить мерой окислительно-восстановительной способности системы. Однако невозможно произвести измерение такого скачка потенциала или, что то же, разности потенциалов между двумя фазами. Но можно произвести измерение э. д. с. элементов, составленных из интересующих нас электродов и какого-нибудь одного (одинакового во всех случаях) электрода, потенциал которого условно принят за нуль.
Измеренная э. д. с. будет характеризовать окислительно-восстановительную способность интересующего нас электрода относительно некоторого условного нуля. Полученная таким способом величина называется собственным потенциалом металла.
Чтобы измерить электродный потенциал любого металла, необходимо поместить в электролит второй электрод, который и свою очередь будет обладать определенным электродным потенциалом, зависящим от его материала. Следовательно, непосредственно измерить можно только алгебраическую сумму двух электродных потенциалов.
По этой причине электродные потенциалы различных материалов определяются по отношению к стандартному (водородному электроду, потенциал которого условно принимают за нуль.
Для измерения могут применяться и другие электроды сравнения, потенциал которых относительно водородного стандартного электрода известен. Этот потенциал также находят на основании измерения э. д. с. цепи, составленной из выбранного электрода сравнения и стандартного водородного электрода.
Если изучаемый электрод в паре со стандартным водородным электродом является отрицательным, то собственному потенциалу приписывается знак «-«, в противном случае — знак «+».
Например, измеренный таким образом в растворе соответствующей соли металла электродный потенциал цинка -0,76 В, меди +0,34 В, серебра +0,8 В. Э. д. с, которую дает элемент, определяется вычитанием потенциала более отрицательного из потенциала более положительного.
Если в соответствующий электролит помещены две пластины из металлов, имеющих различный электродный потенциал, например, в раствор серной кислоты (H2SO4) помещены цинковая (Zn) и медная (С u ) пластины, то вольтметр, присоединенный к этим пластинам, покажет между ними напряжение немного более 1 В.
Это напряжение, называемое в данном случае э. д. с. гальванической пары, будет обусловлено разностью электродных потенциалов меди, обладающей небольшим положительным потенциалам, и цинка, обладающего значительным отрицательным потенциалом. Такое устройство является простейшим гальваническим элементом — элементом Вольта.
В гальваническом элементе происходит превращение химической энергии в электрическую и с его помощью можно совершить электрическую работу за счет энергии химической реакции.

Измерение э. д. с. гальванических элементов необходимо производить при отсутствии тока в цепи элемента. В противном случае измеренная э. д. с. будет меньше, чем величина, определяемая как разность равновесных потенциалов обоих электродов. Действительно, равновесному потенциалу отвечает определенная концентрация электронов на электродах: на более положительном она ниже, на более отрицательном выше. Сообразно с этим различно и строение той части двойного слоя, которая расположена в растворе.
Измерение э. д. с. элемента без протекания тока обычно производится компенсационным методом. Для осуществления его необходимо иметь некоторый эталон э. д. с. Таким эталоном служит так называемый нормальный элемент. Чаще всего пользуются ртутно-кадмиевым нормальным элементом Вестона, э. д. с. которого равна 1,01830 В при 20 °С.
главная > справочник > химическая энциклопедия:
Электродный потенциал
Электродный потенциал, разность электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродный потенциал обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. На границе между металлическим электродом и раствором электролита пространственное разделение зарядов связано со следующим явлениями: переносом ионов из металла в раствор в ходе установления электрохимического равновесия, кулоновской адсорбцией ионов из раствора на поверхность металла, смещением электронного газа за пределы положительно заряженного ионного остова кристаллической решетки, специфической (некулоновской) адсорбцией ионов или полярных молекул растворителя на электроде и др. Последние два явления приводят к тому, что электродный потенциал не равен нулю даже при условиях, когда заряд поверхности металла равен нулю.
Абсолютную величину электродный потенциал отдельного электрода определить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и некоторого стандартного электрода сравнения электродный потенциал равен эдс электрохимической цепи, составленной из исследуемого и стандартного электродов (диффузионный потенциалмежду разными электролитами, обусловленный различием скоростей движения ионов, при этом должен быть устранен). Для водных растворов в качестве стандартного электрода обычно используют водородный электрод (Pt, Н2[0,101 МПа] | Н + [a= 1]), потенциал которого при давлении водорода 0,101 МПа и термодинамической активности а ионов Н + в растворе, равной 1, принимают условно равным нулю (водородная шкала электродных потенциалов). При схематическом изображении цепи водородный электрод всегда записывают слева; например, потенциал медного электрода в растворе соли меди равен эдс цепи Pt, H2|HCl  CuCl2|Cu|Pt (две штриховые черты означают, что диффузионный потенциал на границе НСl и СuСl2 устранен).
CuCl2|Cu|Pt (две штриховые черты означают, что диффузионный потенциал на границе НСl и СuСl2 устранен).
Если исследуемый электрод находится в стандартных условиях, когда активности всех ионов, определяющих электродный потенциал, равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение электродный потенциал наз. стандартным (обозначение E°).
Оно связано со стандартным изменением энергии Гиббса 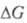 и константой равновесия Кр электрохимической реакции уравнением:
и константой равновесия Кр электрохимической реакции уравнением: 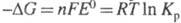 , где F — число Фарадея; n — число электронов, участвующих в реакции; R — газовая постоянная; Т — абс. температура. Значения E° электрохимических систем по отношению к водородному электроду и протекающие на электродах реакции сведены в специальные таблицы.
, где F — число Фарадея; n — число электронов, участвующих в реакции; R — газовая постоянная; Т — абс. температура. Значения E° электрохимических систем по отношению к водородному электроду и протекающие на электродах реакции сведены в специальные таблицы.
Зависимость электродного потенциала от термодинамических активностей ai участников электрохимической реакции выражается уравнением Нернста:
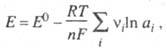
где vi — стехиометрический коэффициент участника реакции, причем для исходных веществ это отрицательная величина, а для продуктов реакции — положительная.
Если через электрод протекает электрический ток, электродный потенциал отклоняется от равновесного значения из-за конечной скорости процессов, происходящих непосредственно на границе электрод – электролит.
Что такое электродный потенциал?
С. И. ЛЕВЧЕНКОВ
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.1 Электрические потенциалы на фазовых границах
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди.
При погружении медного электрода в воду часть ионов меди, находящихся в узлах кристаллической решетки, в результате взаимодействия с диполями воды будет переходить в раствор. Возникающий при этом на электроде отрицательный заряд будет удерживать перешедшие в раствор ионы в приэлектродном пространстве – образуется двойной электрический слой (рис. 3.12а; о моделях строения ДЭС смотрите п. 4.2.4). Отрицательный заряд на электроде будет препятствовать дальнейшему переходу ионов меди в раствор, и через некоторое время установится динамическое равновесие, которое можно однозначно охарактеризовать потенциалом электрического поля ДЭС Φ, зависящего от заряда на электроде, или некоторой равновесной концентрацией ионов в приэлектродном слое Сo. При погружении медного электрода в раствор СuSО4, содержащий ионы меди в концентрации С возможны три случая:
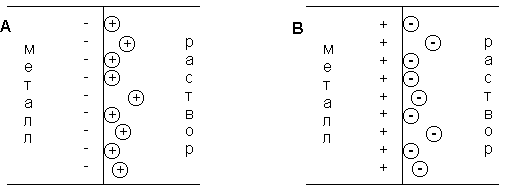
Рис. 3.12 Схема двойного электрического слоя на границе электрод-раствор
1. С Сo. Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО4 2- (рис. 3.12b).
3. С = Сo. Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
3.5.2 Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn 2+ // Cu 2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом , электрод, на котором идет процесс восстановления – катодом . При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
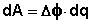 (III.39)
(III.39)
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента .
3.5.3 Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода ε э называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как «разность потенциалов на границе электрод – раствор», т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
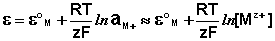 (III.40)
(III.40)
В уравнении Нернста ε ° – стандартный электродный потенциал , равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε ° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
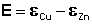 (III.41)
(III.41)
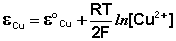 (III.42)
(III.42)
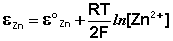 (III.43)
(III.43)
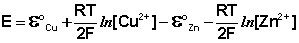 (III.44)
(III.44)
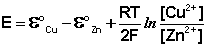 (III.45)
(III.45)
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
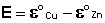 (III.46)
(III.46)
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu 2+ ] 2+ ] становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
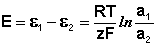 (III.47)
(III.47)
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Copyright © С. И. Левченков, 1996 — 2005.
Что такое электродный потенциал?
Если же процессы окисления и восстановления пространственно разделить, то любую окислительно-восстановительную реакцию можно использовать для получения электрической энергии. Такие устройства называют химическими источниками тока (ХИТ). Простейший ХИТ – гальваническая ячейка (рис. 7.1) – представляет собой сосуды, в которых два электрода, помещенные в раствор соответствующих электролитов, соединены солевым мостиком (проводником второго рода *) , представляющим собой стеклянную трубку, заполненную раствором такого электролита, катионы и анионы которого характеризуются одинаковой подвижностью. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС).
*) В проводниках второго рода носителями заряда служат ионы, в отличие от электронов в проводниках первого рода.
отражает современную систему обозначений для гальванических элементов. Слева записывается анод Zn¦Zn 2+ , на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс (–). Справа – катод Cu 2+ ¦Cu – электрод с недостатком электронов, положительный полюс (+). Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного.
Электроны по внешнему участку цепи, металлическому проводнику, переходят от отрицательного полюса к положительному. Внешнюю цепь на схеме не изображают. В круглых скобках знаками плюс и минус обозначают полюсы электродов.
Рассмотрим системы металл–растворитель и металл–электролит. В этих гетерогенных системах в зависимости от природы металла и электролита возможен переход ионов металла в раствор или ионов металла из раствора на поверхность металла. Эти процессы определяются отношением энтальпии отрыва иона от кристаллической решетки металла () и энтальпии сольватации этого иона M ∙ solv(solv).
В результате на фазовой границе металл–электролит устанавливается равновесие:
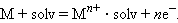
|
Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в раствор равновесие смещается вправо, что приводит к отрицательному заряду на металле по отношению к раствору. Если малоактивный металл погружен в раствор соли с концентрацией больше равновесной, то происходит переход ионов из раствора на металл, заряженный положительно (рис. 7.2). В любом случае возникает двойной электрический слой, и появляется разность электрических потенциалов, или гальвани-потенциал.
Система, состоящая из металла, погруженного в раствор электролита, называется электродом, то есть электроды в электрохимии – это системы из двух токопроводящих тел: проводников 1 и 2 рода . Абсолютное значение разности потенциалов на границе двух фаз разной природы металл│электролит измерить нельзя, однако можно измерить разность потенциалов двух различных электродов.
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л –1 , обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при K
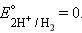
|
Платиновая чернь адсорбирует водород, который электрохимически взаимодействует с H + по уравнению
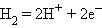
|
Для гальванического элемента
| (–)Pt, H2¦2H + ||M¦M(+), |
в котором протекает окислительно-восстановительная реакция
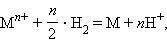
|
запишем уравнение изотермы
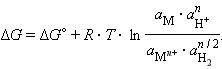
|
Уравнение (7.1) выражает зависимость электродного потенциала от концентрации (активности) ионов и температуры и называется уравнением Нернста для отдельного электрода .
Отметив, что 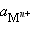 – активность окисленной формы реагента (оф), M – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде:
– активность окисленной формы реагента (оф), M – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде:
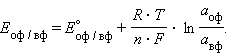
|
Перейдя от натуральных логарифмов к десятичным и подставив численные значения , и , получим удобную для расчетов форму уравнения Нернста:
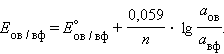
|
Потенциал электрода, как видно из этого уравнения, зависит от активности ионов 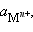 которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается .
которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается .
Следует подчеркнуть, что:
Уравнение Нернста отдельного электрода условились писать для процесса восстановления независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе стоит окисленная форма реагента, в знаменателе – восстановленная.
В дробном индексе при и над чертой ставится окисленная форма полуэлемента, под чертой – восстановленная.
Активности твердых веществ в уравнение Нернста не входят.
Значения некоторых стандартных окислительно-восстановительных потенциалов гальванических элементов, расположенных в порядке их возрастания, представлены в таб. 7.1.
Уравнение Нернста. Потенциометрические методы анализа
Потенциометрические методы основаны на измерении электродвижущих сил (ЭДС):
где E — электродвижущая сила (ЭДС);
E1 и E2 — потенциалы электродов исследуемой цепи.
Потенциал электрода E связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста:
где E0 — стандартный потенциал редокс-системы;
R — универсальная газовая постоянная, равная 8,312 Дж/(моль К);
T — абсолютная температура, К;
F — постоянная Фарадея, равная 96485 Кл/моль;
n — число электронов, принимающих участие в электродной реакции;
aox, ared — активности соответственно окисленной и восстановленной форм редокс-системы;
[ox], [red] — их молярные концентрации;
Гox, Гred — коэффициенты активности.
E=E при aox = ared = 1, причем имеется в виду гипотетический стандартный 1 М раствор, в котором коэффициент активности каждого растворенного вещества равен 1, а чистые вещества находятся в наиболее устойчивом физическом состоянии при данной температуре и нормальном атмосферном давлении.
Подставляя T=298,15 и числовые значения констант в уравнение, получаем для 25 °C
Однако потенциал отдельного электрода экспериментально определить невозможно. Относительные значения электродного потенциала находят, комбинируя данный электрод со стандартным водородным электродом, который является общепринятым международным стандартом. Потенциал водородного электрода принят равным нулю при всех температурах, поэтому потенциал данного электрода — это, в сущности, ЭДС элемента, состоящего из данного и стандартного водородного электрода.
Конструктивно стандартный водородный электрод представляет собой платинированную платиновую пластинку, омываемую газообразным водородом при давлении 1,013 . 10 5 Па (1 атм) и погруженную в раствор кислоты с активностью ионов H + , равной единице. При работе водородного электрода протекает реакция
В практической работе вместо хрупкого и нередко капризного водородного электрода применяют специальные, более удобные в работе стабильные электроды сравнения, потенциал которых по отношению к стандартному водородному электроду точно известен.
Уравнение (2) можно переписать
Величину E‘ называют формальным потенциалом. Как видно, формальный потенциал характеризует систему, в которой концентрации (а не активности) всех участников равны 1,0 моль/л. Формальный потенциал включает в себя коэффициенты активности, т.е. зависит от ионной силы раствора. Если коэффициент активности равен 1, то E‘=E, т.е. формальный потенциал совпадает со стандартным. Точность такого приближения для многих расчетов оказывается достаточной.
Природа возникновения потенциала различна. Можно выделить следующие три основные классы потенциалов, которые не исчерпывают, конечно, всего многообразия. Это:
- Электродные потенциалы.
- Редокс-потенциалы.
- Мембранные потенциалы.
Хотя по термином «электродный потенциал» нередко имеют в виду любой потенциал, независимо от механизма его возникновения, в более узком понимании — это потенциал непосредственно связанный с материалом электрода. Например, цинковый электрод:
Zn 2+ + 2e — = Zn
Активность свободного металла принимается равной единице. Электродные потенциалы отличаются от редокс-потенциалов, для которых материал электрода не имеет значения, так как они химически инертны по отношению ко всем веществам в растворе, и от мембранных, для которых разность потенциалов на мембране измеряется с помощью пары других (в принципе, возможно, одинаковых) электродов.
Потенциометрические методы анализа известны с конца прошлого века, когда Нернст вывел (1889) известное уравнение (1), а Беренд сообщил (1883) о первом потенциометрическом титровании. Интенсивное развитие потенциометрии в последние годы связано, главным образом, с появлением разнообразных типов ионоселективных электродов, позволяющих проводить прямые определения концентрации многих ионов в растворе, и успехами в конструировании и массовом выпуске приборов для потенциометрических измерений.
Потенциометрические методы анализа подразделяют на прямую потенциометрию (ионометрию) и потенциометрическое титрование. Методы прямой потенциометрии основаны на прямом применении уравнения Нернста (1) для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной ЭДС цепи или потенциалу соответствующего электрода. При потенциометрическом титровании точку эквивалентности определяют по резкому изменению (скачку) потенциала вблизи точки эквивалентности.
Васильев В. П. Аналитическая химия. В 2 кн. Кн. 2. Физико-химические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технол. спец. — 2-е изд., перераб. и доп. — М.:Дрофа, 2002. — 384 с., ил. — С. 179-181.
10.3. Электродный потенциал
При погружении металлической пластинки (электрода) в раствор электролита между пластинкой и раствором возникает скачок потенциала. Почему это происходит? в узлах кристаллической решетки металла находятся положительно заряженные ионы. В результате взаимодействия с полярными молекулами растворителя они отрываются и переходят в раствор. Параллельно происходит и обратный процесс. Если в первый момент скорость процесса перехода ионов из раствора в металл меньше скорости прямого перехода, то металл приобретает избыточный отрицательный заряд. Положительно заряженные ионы не удаляются от поверхности металла, а накапливаются у его поверхности. В результате образуется двойной электрический слой, в котором и возникает скачок потенциала.
Возможна и такая ситуация, когда скорость перехода ионов из раствора больше скорости перехода ионов в раствор. В этом случае поверхность металла зарядится положительно. Со временем и в том, и в другом случае в системе установится равновесие, поскольку переход в раствор и из раствора каждого последующего иона будет сопряжен с преодолением все большего энергетического барьера, связанного с возрастанием заряда металла (например, отрицательного при переходе ионов в раствор).
Таким образом, по мере увеличения отрицательного заряда будет уменьшаться разность электрохимических потенциалов мири разность скоростейV1иV2. Изменение электрохимических потенциалов будет сопровождаться изменением скачка потенциала на границе металл – раствор. В конце концовм=ри установится динамическое равновесие.
Такая картина может быть экспериментально подтверждена с помощью радиоактивных индикаторов. Например, это было сделано с использованием висмута, содержащего радиоактивный изотоп.
Условились считать заряд электрода по заряду металла. Если металлическая пластинка заряжена отрицательно, то электрод считается отрицательным. Однако в электрохимической системе (гальваническом элементе), состоящей из двух электродов, независимо от знака заряда каждого электрода знак «плюс» электрода определяется относительной заряженностью электродов, составляющих элемент.
Переход ионов металла в раствор (анодный процесс):
М М z + +Ze — .
Переход ионов в металл (катодный процесс):
Так как оба процесса (прямой и обратный) связаны с переносом электрического заряда, то их скорости эквивалентны определенной величине тока I. Для расчетов обычно величину тока относят к единице поверхности электродаS. Это отношение называют плотностью тока:
В момент равновесия скорости переноса одинаковы. Тогда при условии, что Sk=Sa(одинаковы) и величина анодной и катодной плотностей тока составляет
где io– ток обмена, который характеризует кинетику обмена в момент равновесия, максимальная работа перехода ионов из металла в раствор в момент равновесия прир=constравна:
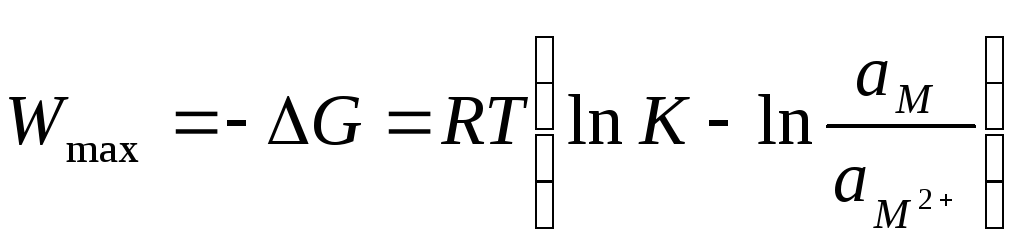 , (10.13)
, (10.13)
где ам 2+ – активность ионов металла в растворе,ам– активность ионов металла в металле. Последняя равна 1. Электрическая работа при этом равна
где – величина скачка потенциала на границе металл-электролит. Сопоставив (10.13) и (10.14), получим:
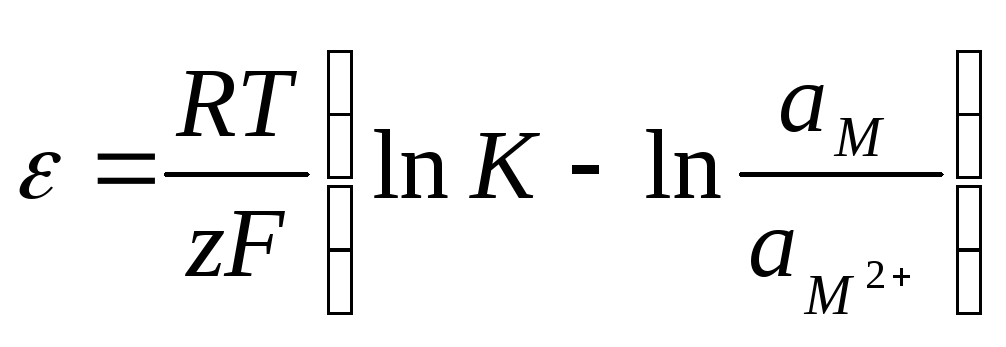 . (10.15)
. (10.15)
Величину скачка потенциала, как ЭДС, выражают в вольтах. Помня, что ам= 1, и перейдя к десятичным логарифмам, получим:
 . (10.16)
. (10.16)
При постоянной температуре первый член в правой части содержит только постоянные величины и, следовательно, является постоянной величиной. Обозначим ее через о. Тогда
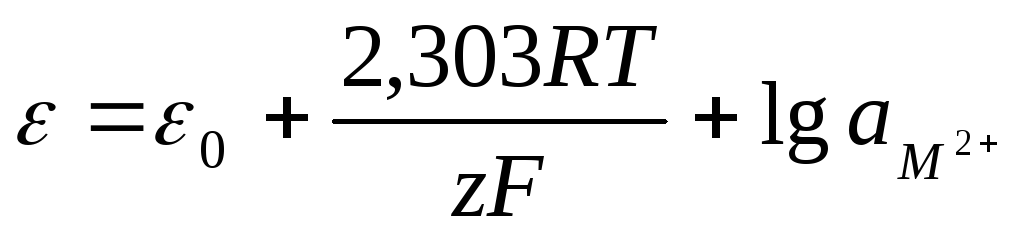 . (10.17)
. (10.17)
Определим физический смысл величины о.. Если активность потенциал-определяющих ионов равна единице, т.е.амZ+ = 1, в этом случаео =, т.е.о– это электродный потенциал, который возникает при погружении металла в раствор, в котором активность ионов металла равна 1 моль/л. Эта величина получила название стандартного электродного потенциала. Уравнение (10.17) было впервые выведено в 1890 году В. Нернстом и получило название уравнения Нернста.
Так как не существует ни теоретических, ни экспериментальных методов определения величины о, то его значения становятся определенными только при выборе условного нуля отсчета. В качестве такового выбран потенциал стандартного водородного электрода. Потенциалы всех остальных электродов сравниваются с потенциалом стандартного водородного электрода.
Величина ЭДС, измеренная по отношению (в гальваническом элементе) к стандартному водородному электроду, и есть величина электродного потенциала по водородной шкале.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
Большой Энциклопедический словарь . 2000 .
- ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ
- ЭЛЕКТРОДУГОВАЯ СВАРКА
Смотреть что такое «ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ» в других словарях:
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — разность электрических потенциалов (напряжений) между электродом и находящимся с ним в контакте электролитом. Появление Э. п. вызвано образованием у поверхности электрода двойного электрического слоя. На практике используют значения так… … Большая политехническая энциклопедия
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, мера способности электрода вступать в реакцию. Электрод из элемента М, помещенный в раствор его ионов (М+), представляет собой ПОЛУЭЛЕМЕНТ. Теоретически в ходе реакций типа ММ++е между электродом и раствором всегда… … Научно-технический энциклопедический словарь
Электродный потенциал — мера способности электрода вступать в реакцию. Между электродом и раствором всегда образуется разность потенциалов. Стандартные потенциалы электродов определяют относительно водородного электрода при определенных величинах температуры,… … Официальная терминология
электродный потенциал — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN electrode potentialelectrolytic potentialelectropolarization… … Справочник технического переводчика
электродный потенциал — [electrode potential] разность электрических потенциалов между электродами и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Практическое значение имеют относительные электродные потенциалы,… … Энциклопедический словарь по металлургии
электродный потенциал — 3.8 электродный потенциал: Мера способности электрода вступать в реакцию. Между электродом и раствором всегда образуется разность потенциалов. Стандартные потенциалы электродов определяют относительно водородного электрода при определенных… … Словарь-справочник терминов нормативно-технической документации
Электродный потенциал — У этого термина существуют и другие значения, см. Потенциал. Электродный потенциал разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение… … Википедия
Электродный потенциал — Electrode potential Электродный потенциал. Потенциал электрода в электролизе измеренный относительно электрода сравнения. В электродный потенциал не входят потери противодействия потенциалу, как в растворе, так и внешней цепи. Он представляет… … Словарь металлургических терминов
электродный потенциал — elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Dydis, išreiškiamas potencialų skirtumu, susidarančiu tarp joninės terpės (elektrolito tirpalo ar lydalo) ir į ją įdėto elektrodo. atitikmenys: angl. electrode… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
электродный потенциал — elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Elektrodo potencialas kito kūno arba terpės, kurioje jis yra, atžvilgiu. atitikmenys: angl. electrode potential vok. Elektrodenpotential, n rus. потенциал электрода … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Что такое электродный потенциал?

Введение
Согласно классическим представлениям теоретической электрохимии [1], гальвани-потенциал границы раздела металл/металл является постоянной величиной. Гальвани-потенциал границы раздела металл/полупроводник зависит от концентрации электронов в полупроводнике. Однако ЭДС электрохимической цепи «электрод сравнения — полупроводниковый электрод» от концентрации электронов в полупроводнике не зависит [5]. Представляет интерес рассмотреть такую зависимость для интеркалатного электрода из углеродного материала.
Многие слоистые кристаллические структуры, в том числе графит, имеют прочную связь атомов внутри слоёв и слабую связь между слоями, обеспечиваемую ван-дер-ваальсовыми силами. Такая особенность строения позволяет внедрить между слоями исходного материала, называемого также веществом — «хозяином», дополнительные атомы, которые являются «гостями» по отношению к хозяину. Процесс образования подобного соединения (внедрения) в настоящее время называют интеркалацией от латинского intercalarius [7] или intercalatus [2] — вставной, добавочный.
Принимая для обозначения «хозяина» (от host — хозяин), рассматриваемый нами тип интеркалатного электрода (ИЭ) уместно обозначить , показывая наличие в структуре хозяина «гостя», атома Li. Учитывая, что содержание лития в материале хозяина неопределённо и переменно, правильнее обозначение . Атом Li в структуре ИЭ представлен ионом лития и электроном, так что можно записать также º + хe — х>. Условие равновесия электронов на границе раздела /Li:
Δφ Li = φ Li — φ HLi х> = 1/eN(mе Li — mе HLi х> ) . (1)
Поскольку химический потенциал электронов в металле постоянен, а для хозяина справедливо выражение: μе HLi х> = 1/eN (μе 0 HLi х> + RT ln a е HLi х> ), то гальвани-потенциал для границы раздела /Li равен Δφ Li = const — kT/e ln a е HLi х> , при этом const = 1/eN(μе Li — μе 0 HLi х> ). Из этого видно, что гальвани-потенциал границы раздела ИЭ/ литий аналогичен гальвани-потенциалу для полупроводников, т.е. зависит от концентрации электронов.
Рассмотрим электрохимическую цепь «литий — ИЭ», представляющую собой потенциал интеркалатного электрода относительно литиевого электрода сравнения: Li|АДР,Li +| + х ` e>|Li. Для упрощения записей введём обозначение º + х ` e>.
Разность потенциалов этой цепи складывается из трёх гальвани-потенциалов, отвечающих трём границам раздела, для которых существует равновесие: Li ↔ Li + (p) + e (Li); Li + (p) ↔ Li + ( ); e ( ) ↔ e (Li), откуда гальвани-потенциал каждой фазовой границы равен:
ΔφLi p = φ p — φ Li = 1/eN (- μLi+ p — μe Li );
Δφ Li = φ Li — φ = 1/eN (μe Li — μe ) . (2)
Подставив уравнения (2) в уравнение: E = φLi P + φP H > + φ Li и проведя сокращения, получаем:
Для ионов лития и электронов:
— μe H > = — (μ 0 e H > + kNT ln a e ), где — μ 0 e = сonst2.
Приняв 1/eN (cost1 + const2) = E 0 , имеем:
Из уравнения (8) следует, что ЭДС электрохимической цепи «Li + /Li — ИЭ» зависит и от концентрации электронов, и от концентрации ионов в материале интеркалатного электрода. В этом состоит коренное отличие интеркалатных электродов от электродов всех других типов, в том числе и амальгамных. Уравнение (4) представляет собой уравнение Нернста для потенциала ИЭ. Аналогичные результаты получены в [9]. Однако они представлены в виде, затрудняющем расчёт. Для анализа удобнее уравнение (4) представить в виде:
E = E 0 — kT/e ln aLi+ — kT/e ln ae . (5)
Концентрация электронов в металлах составляет
1·10 28 м — 3 , в полупроводниках изменяется в широких пределах от 1·10 19 до 1·10 25 м — 3 [5].
Используя теоретическую плотность графита 2,267 г/см 3 [3], можно представить концентрацию электронов в графите в виде количества частиц на грамм вещества. В 1 г незаряженного графита может находиться от 1·10 13 /2,267 = 4,41·10 12 до 1·10 19 /2,267 = 4,41·10 18 е/г, т.е. для степени внедрения х = 1 в грамм графита интеркалирует 8·10 21 атомов лития.
Заряд электрона е = 1,6·10 -19 Кулон, и при прохождении 1 Кулона (1 Ас) переносится 6,25·10 18 электронов. Отсюда при расходовании в процессе заряда или разряда графитового электрода 1 мАч в материал электрода переносится по 2,25·10 19 заряженных частиц, равно электронов и ионов лития.
Рассмотрим зависимость потенциала ИЭ от концентрации электронов и ионов. Используем уравнение (3) в виде:
E = E 0 — kT/e ln aLi+ — kT/e ln ae , (6)
где: E — потенциал графитового электрода относительно литиевого электрода сравнения.
Для оценки E 0 примем, что при х = 1 (372 мАч/г), Е = 0. Тогда E 0 = — kT/e ln aLi+ H > — kT/e ln ae H > . Полагая активности ионов лития и электронов равными концентрации, имеем E 0 = 0,06·2 lg 372·2,25 ·10 19 = 2,631 В.
Исходное состояние: аLi+ H > = 0; aе H > = 4,4·10 12 е/г (минимальное из оговоренных в литературе для полупроводников значений). Исходное значение Е = 2,631 — 0,06 lg 4,4·10 12 = 2,631 — 0,759 = 1,872 В. Расчёт даёт для изменения потенциала ИЭ от глубины заряда х зависимость, приведенную в таблице 1.
Получаемая из данных таблицы 1 зависимость находит подтверждение только в части экспериментальных данных. Таким образом, расчёт по уравнению (4), выведенному на основе классических представлений, не может быть распространён на все случаи реального поведения бестокового потенциала углеродного электрода. Попробуем разобраться в этом несоответствии.
Слоистые соединения графита с литием были получены впервые химически в 1955-1965 гг. обработкой графита парами лития [6]. Основной особенностью образования слоистых соединений, названных также соединениями внедрения, обнаруженной при их изучении, явилось ступенчатое послойное заполнение графита щелочным металлом.
Таблица 1 — Зависимость потенциала Е от глубины заряда графита Х
Электродный потенциал — Electrode potential
В электрохимии , электродный потенциал является электродвижущей силой из гальванического элемента , построенный из стандартного опорного электрода и другой электрода быть охарактеризован. По соглашению электродом сравнения является стандартный водородный электрод (SHE). Она определяется , чтобы иметь потенциал нуля вольт .
Электродный потенциал возникает из разности потенциалов, возникающей на границе раздела между электродом и электролитом . Например, принято говорить об электродном потенциале окислительно-восстановительной пары M + / M.
Содержание
- 1 Происхождение и интерпретация
- 2 Измерение
- 3 Соглашения о знаках
- 4 Разность потенциалов ячейки, собранной из двух электродов
- 5 См. Также
- 6 Ссылки
Происхождение и интерпретация
Электродный потенциал появляется на границе раздела между электродом и электролитом из-за переноса заряженных частиц через поверхность раздела, специфической адсорбции ионов на границе раздела и специфической адсорбции / ориентации полярных молекул, включая молекулы растворителя.
В электрохимической ячейке катод и анод независимо имеют определенный электродный потенциал, и разница между ними составляет потенциал ячейки:
Е ячейки = Е катод — Е анод .
Электродный потенциал может быть либо равновесным на рабочем электроде («обратимый потенциал»), либо потенциалом с ненулевой результирующей реакцией на рабочем электроде, но нулевым результирующим током («потенциал коррозии», « смешанный потенциал »), или потенциал с ненулевым чистым током на рабочем электроде (как при гальванической коррозии или вольтамперометрии ). Обратимые потенциалы иногда можно преобразовать в стандартный потенциал электрода для данного электроактивного вещества путем экстраполяции измеренных значений в стандартное состояние .
Величина электродного потенциала в неравновесном состоянии зависит от природы и состава контактирующих фаз, а также от кинетики электродных реакций на границе раздела (см. Уравнение Батлера – Фольмера ).
Рабочее предположение для определения электродных потенциалов со стандартным водородным электродом включает использование этого электрода сравнения с ионом водорода в идеальном растворе, имеющем «нулевой потенциал при всех температурах», что эквивалентно стандартной энтальпии образования иона водорода, также «нулевой при всех температурах». «.
Измерение

Измерение обычно проводится на трехэлектродной установке (см. Рисунок):
- рабочий электрод ,
- противоэлектрод ,
- электрод сравнения (стандартный водородный электрод или аналог).
В случае ненулевого сетевого тока на электроде важно минимизировать омическое падение ИК-излучения в электролите, например, путем размещения электрода сравнения рядом с поверхностью рабочего электрода (например, см. Капилляр Луггина ) или с помощью с использованием поддерживающего электролита с достаточно высокой проводимостью . Измерения потенциала выполняются, когда положительный вывод электрометра подключен к рабочему электроду, а отрицательный вывод — к электроду сравнения.
Знаковые соглашения
Исторически сложилось так, что для знака потенциала электрода сформировались два соглашения:
- конвенция « Нернст — Льюис — Латимер » (иногда именуемая «американская»),
- конвенция « Гиббс — Оствальд — Стокгольм » (иногда именуемая «Европейской»).
В 1953 г. в Стокгольме ИЮПАК признал, что любая из конвенций допустима; однако он единодушно рекомендовал называть «электродным потенциалом» только величину, выраженную в соответствии с соглашением (2). Чтобы избежать возможных двусмысленностей, определяемый таким образом потенциал электрода можно также называть электродным потенциалом Гиббса – Стокгольма . В обоих соглашениях стандартный водородный электрод определяется как имеющий потенциал 0 В. Оба соглашения также согласовывают знак E для реакции полуэлемента, когда он записывается как восстановление.
Основное различие между этими двумя соглашениями состоит в том, что при изменении направления реакции полуячейки, как написано , согласно соглашению (1) знак E также переключается, тогда как в соглашении (2) этого не происходит. Логика переключения знака E состоит в том, чтобы поддерживать правильное соотношение знаков с изменением свободной энергии Гиббса, задаваемое формулой Δ G = — nFE, где n — количество вовлеченных электронов, а F — постоянная Фарадея . Предполагается, что полуреакция уравновешивается соответствующей полуреакцией SHE. Так как Δ G переключает знак , когда реакция записывается в обратном, так же, сторонники конвенции (1) утверждают, должны знак Е . Сторонники соглашения (2) утверждают, что все сообщаемые электродные потенциалы должны соответствовать электростатическому знаку относительной разности потенциалов.
Разность потенциалов ячейки, собранной из двух электродов
Потенциал ячейки, состоящей из двух электродов, можно определить из потенциалов двух отдельных электродов, используя
Δ V ячейка = E красный, катод — E красный, анод
или, что то же самое,
Δ V ячейка = E красный, катод + E кислород, анод .
Это следует из определения разности электрических потенциалов гальванического элемента ИЮПАК, согласно которому разность электрических потенциалов элемента — это разность потенциалов электродов справа и слева от гальванического элемента. Когда Δ V элемента является положительным, то положительный электрический заряд проходит через элемент от левого электрода ( анода ) к правому электроду ( катоду ).
Что такое электродный потенциал?
В электрохимической ячейке (гальваническом элементе) электроны, остающиеся после образования ионов, удаляются через металлический провод и рекомбинируют с ионами другого вида. Т.е.заряд во внешней цепи переносится электронами, а внутри ячейки, через электролит, в который погружены металлические электроды, ионами. Таким образом получается замкнутая электрическая цепь.
Разность потенциалов, измеряемая в электрохимической ячейке, o бъясняется различием в способности каждого из металлов отдавать электроны. Каждый электрод имеет собственный потенциал, каждая система электрод-электролит представляет собой полуэлемент, а любые два полуэлемента образуют электрохимическую ячейку. Потенциал одного электрода называют потенциалом полуэлемента, он определят способность электрода отдавать электроны. Очевидно, что потенциал каждого полуэлемента не зависит от наличия другого полуэлемента и его потенциала. Потенциал полуэлемента определяется концентрацией ионов в электролите и температурой.
В качестве «нулевого» полуэлемента был выбран водород, т.е. считается, что для него при добавлении или удалении электрона с образованием иона никакой работы не совершается. «Нулевое» значение потенциала необходимо для понимания относительной способности каждого из двух полуэлементов ячейки отдавать и принимать электроны.
Потенциалы полуэлементов, измеряемые относительно водородного электрода, называются водородной шкалой. Если термодинамическая склонность отдавать электроны в одной половине электрохимической ячейки выше, чем в другой, то потенциал первою полуэлемента выше, чем потенциал второго. Под действием разности потенциалов будет происходить переток электронов. При сочетании двух металлов можно выяснить возникающую между ними разность потенциалов и направление потока электронов.
Электроположительный металл обладает более высокой способностью принимать электроны, поэтому он будет катодным или благородным. С другой стороны находятся электроотрицательные металлы, которые способны самопроизвольно отдавать электроны. Эти металлы являются реакционноспособными, а, следовательно, анодными:
Al Mn Zn Fe Sn Pb H 2 Cu Ag Au
Например, Cu отдает электроны легче Ag , но хуже Fe . В присутствии медного электрода ноны серебра начнут соединяться с электронами, приводя к образованию ионов меди и осаждению металлического серебра:
2 Ag + + Cu → Cu 2+ + 2 Ag
Однако та же самая медь менее реакционноспособна, чем железо. При контакте металлического железа с нонами меди та будет осаждаться, а железо переходить в раствор:
Fe + Cu 2+ → Fe 2+ + Cu .
Можно говорить, что медь является катодным металлом относительно железа и анодным — относительно серебра.
Стандартным электродным потенциалом считается потенциал полуэлемента из полностью отожженого чистого металла в качестве электрода в контакте с ионами при 25 0 С. В этих измерениях водородный электрод выступает в роли электрода сравнения. В случае двухвалентного металла можно записать реакцию, протекающую в соответствующей электро-химической ячейке:
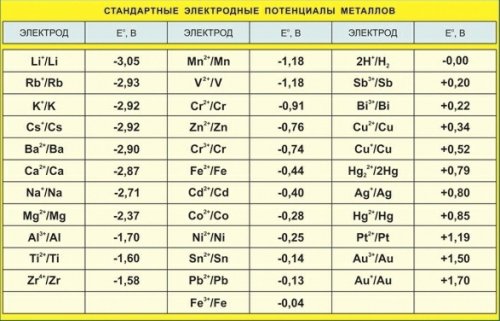
Если упорядочить металлы по убыванию их стандартных электродных потенциалов, то получается так называемый электрохимический ряд напряжений металлов (табл. 1).
Таблица 1. Электрохимический ряд напряжений металлов
Равновесие металл-ионы (единичной активности)
Электродный потенциал относительно водородного электрода при 25°С, В (восстановительный потенциал)



