Понятие атом Строение атома и атомного ядра
Строение атома
Строение атома
Атом (от греческого atomos — неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойств вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (количество нейтронов может быть равно или чуть больше или меньше, чем протонов). Протоны и нейтроны называют нуклонами, то есть частицами ядра. Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома в основном определяется массой его ядра, поскольку масса электрона примерно в 1836 раз меньше массы протона и нейтрона и в расчётах редко учитывается. Точное количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A—Z). Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N), называется нуклидом (это могут быть как разные элементы с одинаковым общим количеством нуклонов (изобары) или нейтронов (изотоны), так и один химический элемент — одно количество протонов, но разное количество нейтронов (изомеры)).
| элементарная частица | заряд (условные единицы) | заряд (Кл) | масса (а.е.м.) | масса (г) |
|---|---|---|---|---|
| протон | +1 | 1,6·10×10 -19 | 1 | 1,7·10×10 -24 |
| нейтрон | 1 | 1,7·10×10 -24 | ||
| электрон | -1 | -1,6·10×10 -19 | 9,1·10×10 -28 |
Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объёмом атома, то ядро условно принимается материальной точкой, покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов.
Свойства электрона
Перед изучением свойств электрона и правил формирования электронных уровней необходимо затронуть историю формирования представлений о строении атома. Мы не будем рассматривать полную историю становления атомарного строения, а остановимся лишь на самых актуальных и наиболее «верных» представлениях, способных наиболее наглядно показать как располагаются электроны в атоме. Первыми наличие атомов как элементарных составляющих вещества предположили еще древнегреческие философы (если какое-либо тело начать делить пополам, половинку ещё пополам и так далее, то этот процесс не сможет происходить до бесконечности; мы остановимся на частичке, которую уже не сможем поделить, — это и будет атом). После чего история строения атома прошла сложный путь и разные представления, такие как неделимость атома, Томсоновская модель атома и другие. Наиболее близкой оказалась модель атома, предложенная Эрнестом Резерфордом в 1911 году. Он сравнил атом с солнечной системой, где в роли солнца выступало ядро атома, а электроны двигались вокруг него подобно планетам. Размещение электронов на стационарных орбитах было очень важным шагом в понимании строения атома. Однако такая планетарная модель строения атома шла в противоречие с классической механикой. Дело в том, что при движении электрона по орбите он должен был терять потенциальную энергию и в конце концов «упасть» на ядро, и атом должен был прекратить свое существование. Такой парадокс был устранен введением постулатов Нильсом Бором. Согласно этим постулатам, электрон двигался по стационарным орбитам вокруг ядра и при нормальных условиях не поглощал и не испускал энергию. Постулаты показывают, что для описания атома законы классической механики не подходят. Такая модель атома называется моделью Бора-Резерфорда. Продолжением планетарного строения атома является квантово-механическая модель атома, согласно которой мы и будем рассматривать электрон.
Электрон является квазичастицей, проявляя корпускулярно-волновой дуализм: он одновременно является и частицей (корпускула), и волной. К свойствам частицы можно отнести массу электрона и его заряд, а к волновым свойствам — способность к дифракции и интерференции. Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля:
λ = h m v , >,>
где λ 



Для электрона невозможно рассчитать траекторию его движения, можно говорить только о вероятности нахождения электрона в том или ином месте вокруг ядра. По этой причине говорят не об орбитах движения электрона вокруг ядра, а об орбиталях — пространстве вокруг ядра, в котором вероятность нахождения электрона превышает 95%. Для электрона невозможно одновременно точно измерить и координату, и скорость (принцип неопределённости Гейзенберга).
<2>>>»> Δ x ∗ m ∗ Δ v > ℏ 2 <2>>> 
где Δ x 

Чем точнее мы измеряем координату электрона, тем больше погрешность в измерении его скорости, и наоборот: чем точнее мы знаем скорость электрона, тем больше неопределённость в его координате.
Наличие волновых свойств у электрона позволяет применить к нему волновое уравнение Шредингера.
∂ 2 Ψ ∂ x 2 + ∂ 2 Ψ ∂ y 2 + ∂ 2 Ψ ∂ z 2 + 8 π 2 m h ( E − V ) Ψ = 0 <^<2>Psi ><2>>>+<^<2>Psi ><2>>>+<^<2>Psi ><2>>>+<8<2>>m>>left(E-Vright)Psi =0>
где E 


Представленное уравнение написано для одноэлектронной системы. Для систем, содержащих более одного электрона, принцип описания остаётся прежним, но уравнение принимает более сложный вид. Графическим решением уравнения Шредингера является геометрия атомных орбиталей. Так, s-орбиталь имеет форму шара, p-орбиталь — форму восьмерки с «узлом» в начале координат (на ядре, где вероятность обнаружения электрона стремится к нулю).
В рамках современной квантово-механической теории электрон описывается набором квантовых чисел: n, l, ml, s и ms. Согласно принципу Паули в одном атоме не может быть двух электронов с полностью идентичным набором всех квантовых чисел.
Главное квантовое число n определяет энергетический уровень электрона, то есть на каком электронном уровне расположен данный электрон. Главное квантовое число может принимать только целочисленные значения больше 0: n=1;2;3. Максимальное значение n для конкретного атома элемента соответствует номеру периода, в котором расположен элемент в периодической таблице Д. И. Менделеева.
Орбитальное (дополнительное) квантовое число l определяет геометрию электронного облака. Может принимать целочисленные значения от 0 до n-1. Для значений дополнительного квантового числа l применяют буквенное обозначение:
| значение l | 1 | 2 | 3 | 4 | |
|---|---|---|---|---|---|
| буквенное обозначение | s | p | d | f | g |
S-орбиталь имеет форму шара, p-орбиталь — форму восьмерки. Остальные орбитали имеют очень сложную структуру, как, например, представленная на рисунке d-орбиталь.
Строение атома и атомного ядра
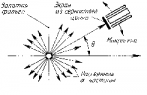
В 1911 году Э. Резерфорд на основе проделанных им экспериментов обосновал наличие в атоме положительно заряженного ядра. Схему опыта Резерфорда вы видите на рисунке. В цилиндре 1 находилось радиоактивное вещество, испускавшее поток α-частиц 2. Они попадали на тонкую золотую фольгу 3 и, взаимодействуя с ней, ударялись об экран 4. В местах ударов частиц на экране возникали вспышки света 5.
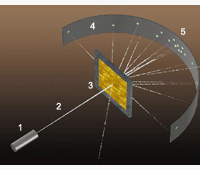
То, что некоторые α-частицы значительно меняли направление полёта, противоречило «рыхлой» модели атома Томсона (см. § 15-б). Резерфорд рассуждал так. Если некоторые α-частицы отлетают назад, значит, сильный положительный заряд есть и в атомах фольги. Но поскольку большая часть α-частиц пролетает сквозь фольгу, почти не отклоняясь, этот положительный заряд занимает малую часть атома. Её назвали ядром атома.
Подсчитывая α-частицы, отклоняющиеся на разные углы, определили размеры ядра атома: около 10 -14 м. Это приблизительно в 10 000 раз меньше самого атома. Поэтому Резерфорду пришлось в своей ядерной модели атома всё незанятое ядром пространство в атоме «заполнить» электронами. Он писал так: «Атом состоит из центрального электрического заряда, сосредоточенного в точке и окружённого однородным сферическим распределением противоположного электричества равной величины».
Резерфорд не указывал, как именно в атоме расположены электроны и движутся ли они. Его эксперимент и не мог дать ответ на этот вопрос, но родилось предположение, что электроны движутся вокруг ядра подобно планетам вокруг Солнца. Однако тогда электроны имели бы центростремительное ускорение (см. § 12-л). И, как и любые движущиеся с ускорением заряды, они излучали бы электромагнитные волны (см. § 11-з). С течением времени, теряя энергию, все электроны неизбежно «упали» бы на ядро. Но размеры никаких атомов не уменьшаются. Значит, гипотеза о движении электронов неверна?
Первый шаг на пути снятия противоречия между планетарной моделью атома и его долговечностью был сделан в 1913 году датчанином Н. Бором. Он развил идеи Планка о квантовании энергии (см. § 15-а) и предположил, что кванты испускаются атомами, а не электронами. Согласно Бору, атомная система (ядро и электроны) может находиться в энергетически устойчивых состояниях, при переходах между которыми испускаются или поглощаются кванты излучения, переносящие энергию.
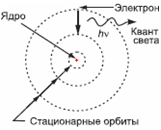
Бору удалось вывести формулу, описывающую положения линий в спектрах водорода и других одновалентных атомов (см. § 14-й). Сделанные расчёты положений спектральных линий совпадали с наблюдаемыми спектрами. Их происхождение теория Бора легко объясняла прерывистым характером допустимых значений энергии атома.
Следующие шаги для понимания причин устойчивости атомов привели к отказу от понятия орбиты электрона в пользу понятий электронных уровней и подуровней. Поэтому с середины XX века планетарная модель в физике не используется. Несмотря на это, квантование энергии атомной системы является одним из главных принципов физики по сей день.
Перейдём к рассмотрению строения ядра атома. В 1919 году Э. Резерфорд, бомбардируя атомы азота ядрами атомов гелия, обнаружил появление ядер атомов водорода. Аналогичная бомбардировка натрия, алюминия, неона и других элементов тоже порождала ядра атомов водорода. Их назвали протонами и сделали вывод, что они входят в состав ядер всех атомов. В 1932 году английский физик Д. Чедвик открыл нейтрон – частицу ядра с массой, равной массе протона, и без электрического заряда.
В настоящее время считается, что атомное ядро состоит из протонов и нейтронов, вместе именуемых нуклонами (лат. «нуклеус» – ядро). Ядра прочны благодаря наличию особых ядерных сил, действующих между всеми нуклонами. Эти силы примерно в 100 раз интенсивнее электрических, но действуют только на расстояниях до 10 -15 м, то есть в пределах ядра.
Строение атома и атомного ядра
Разделы: Физика
Цели урока:
- обеспечить усвоение учащимися знаний о строении атома и атомного ядра;
- сформировать умение извлекать информацию из разных источников и представлять ее в разных видах (таблице, рисунке);
- научить пользоваться Периодической системой химических элементов Д.И. Менделеева для определения состава атома;
- расширить кругозор учащихся.
Задачи урока:
- Сформировать представление об атоме и атомном ядре.
- Обеспечить усвоение учебного материала учащимися в процессе активной информационно-мыслительной деятельности с разными источниками информации изучения нового материала.
- Использовать приемы, способствующие продуктивной деятельности учащихся: работа с Периодической системой химических элементов Д.И.Менделеева для определения состава атома, заполнение таблиц по строению атома.
- Развивать интерес к предмету.
- Воспитывать в детях стремление к овладению знаниями, к поиску интересных фактов.
- Учебник по физике “8 класс” А. В. Перышкин. Дрофа: Москва, 2008 г.
- Периодическая система химических элементов Д.И.Менделеева.
- Таблица фундаментальных физических постоянных.
- Компьютер, экран, мультимедиапроектор.
- Презентация в Microsoft Power Point (Приложение 1).
- Электронное издание — 1С: Физика 7-11 классы из серии “Библиотека наглядных пособий”.
- Организационный момент, мотивационная основа урока.
- Изучение нового материала (работа с учебником, заполнение таблиц).
- Работа с Периодической системой химических элементов Д. И. Менделеева.
- Закрепление знаний.
- Подведение итогов урока.
- Домашнее задание.
- Что такое электрон?
- Кто впервые проделал опыт по определению самого маленького заряда?
- Что вы знаете о заряде электрона и его массе?
- Единица измерения электрического заряда?
- Кому принадлежит открытие электрона?
- На уроках химии вы изучили, что такое атом, его строение.
- Как вы представляете себе строение атома?
- Для чего нужно знать строение атома?
- Почему ученые пытались выяснить строение атома?
- Чем отличаются друг от друга атомы различных химических элементов?
- Что является главной характеристикой данного химического элемента? Почему?
- Какие новые физические понятия вы встретили в тексте?
- Назовите отличие электрона от протона?
- Что можно сказать о массах протона и нейтрона?
- Что изображено на рисунках?
- Каково строение атомов водорода, гелия, лития?
- Если атом потерял один или несколько электронов, что произойдет, можно ли считать его нейтральным? Как называют этот атом?
Учебно-наглядный комплекс:
План урока:
Первый этап урока. Мотивация.
Учитель. Понятие атом существует уже более 2500 лет со времен греческого ученого Демокрита, который считал, что все вещества состоят и мельчайших частиц. Им была выдвинута атомистическая гипотеза, согласно которой все в мире состоит из атомов, различающихся своей формой, порядком и ориентацией в теле; между атомами находится пустота (легенда о яблоке). Слово “ атом” означает “неразрезаемый”, “нерассекаемый”. В России М.В.Ломоносов говорил о мельчайших частицах вещества. Он считал, что существует два вида материи “элементы” (атом), “корпускулы” (молекулы). Английский физик Джон Дальтон ввел понятие атомной массы. Атом представлен как мельчайшая неделимая частица. Однако к концу 19 века появились факты о сложном строении атома. Открытие электрона, частицы, входящей в состав атома, нанесло серьезный удар по представлениям об атоме.
(Слайд 2). На прошлом уроке мы с вами познакомились с понятием электрон (беседа по вопросам пройденного материала):
(Ученики отвечают на вопросы)
(Ученики отвечают на вопросы)
Вывод: (запись в тетради).
Атом — наименьшая частица химического элемента, являющаяся носителем его свойств. Атом в целом не имеет заряда, т.к. он нейтрален.
Цель урока – изучить строение атома и атомного ядра.
Второй этап урока. Изучение нового материала.
Работаем с учебником.
Прочитайте параграф 30 и ответьте на вопросы (слайд 4).
(Учащиеся отвечают на вопросы)
Учитель. Обратимся к таблице фундаментальных физических постоянных.
ЧАСТИЦЫ, ВХОДЯЩИЕ В СОСТАВ АТОМА
Таблица №1 (Слайд 5)
| Название частицы | Обозначение | Заряд (кл) | Масса (кг) |
| Электрон | е | — 1,0219 x 10 -19 | 9,1095 x 10 -31 |
| Протон | p | + 1,60219 x 10 -19 | 1, 6726 x 10 -27 |
| Нейтрон | n | Нет | 1, 6749 x 10 -27 |
В начале века в физике бытовали самые разные и часто фантастические представления о строении атома, которые не нашли четкого обоснования и лишь модель атома, предложенная Джозефом Томсоном (английский физик, открывший электрон, лауреат Нобелевской премии по физике) на долгие годы закрепилась в науке.
Ученик (сообщение). Джозеф Томсон родился в 1856 году в Читем-Хилле вблизи Манчестера. Изучал физику, в 1876 году выиграл стипендию на обучение в Кембридже. С 1884 года профессор физики на кафедре экспериментальной физики в Кембридже. В 1911 г. разработал метод парабол для измерения отношения заряда частицы к ее массе. Согласно его модели, вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны “ вкраплены” в атом, словно изюм в булку. Модель так и назвали “ПУДИНГ С ИЗЮМОМ”, но эта модель не была подтверждена опытами. (Слайд 6) . За научные заслуги награжден медалями Франклина, Фарадея, Копли. Умер Джозеф Томсон в 1940 году.
Учеником Томсона был Эрнест Резерфорд, который позже занял его пост. Родился в 1871 году в Новой Зеландии в семье плотника и учительницы. В 1891 году, будучи студентом, выступил с докладом “Эволюция элементов”, в котором заявил, что все атомы — сложные вещества и построены из одних и тех же составных частей. Тогда все посчитали его “лишенным разума”, но спустя годы он доказал свою правоту.
Учитель. В 1911 году английский физик Эрнест Резерфорд, исследовав состав и строение атома на основе радиоактивности, которая доказывала сложность строения атома, предложил ядерную (планетарную) модель атома. (Слайд 7)
Резерфорд являлся членом Лондонского королевского общества, почетным членом 30 Академий наук, в том числе и Советской Академии наук. В 1908 году удостоен Нобелевской премии за исследование радиоактивности. Его учениками были: Чедвик, Бор, советский физик Петр Капица и другие. Умер Эрнест Резерфорд в 1937 году.
Вывод: Определение планетарной модели атома записываем в тетрадь.
В центре атома находится положительное ядро, состоящее из положительных протонов и нейтральных частиц нейтронов, а вокруг движутся отрицательные электроны. (Слайд 8)
Почему модель атома называют планетарной? В чем ее сходство с Солнечной системой?
Ответы учащихся. (Слайд 9)
Третий этап урока. Работа с Периодической системой химических элементов Д.И. Менделеева.
Учитель. Найдем в таблице натрий.
Как правильно записать элемент?
Что означает число 11?
Строение атомного ядра. (Слайд 10)
M — Массовое число, масса ядра, число нуклонов.
Z — зарядовое число, порядковый номер, число протонов, число электронов, заряд ядра
N — число нейтронов.
N = M — Z – определение числа нейтронов.
Учитель. На основе рисунка 39 учебника, ответьте на следующие вопросы. (Слайд 11)
(Ученики отвечают на вопросы)
Посмотрим, как на практике происходит деление атома лития, бериллия, фтора.
(Flash-анимация “Деление ядра”. — Электронное издание 1С:Школа. Физика. 7-11 классы. Библиотека наглядных пособий.)
Четвертый этап урока. Закрепление знаний (работа в группах).
Класс делится на 5 групп, каждая группа выполняет задание, используя Периодическую систему химических элементов Д.И. Менделеева.
Определить строение атома углерода, алюминия, железа, меди, серебра.
Результаты работы учащихся проверяются с помощью таблицы № 2.
Радиоактивность. Строение атома.
Радиоактивность
1896 г. Французский физик А. Беккерель, изучая явление люминесценции солей урана, установил, что урановая соль испускает лучи неизвестного типа, которые проходят через бумагу, дерево, тонкие металлические пластины, ионизируют воздух.
1897-98 г. Мария Склодовская-Кюри и Пьер Кюри, исследуя урановые руды, обнаружила новые химические элементы: полоний, радий. Явление самопроизвольного превращения неустойчивых изотопов в устойчивые, сопровождающееся испусканием частиц и излучением энергии, называется естественной радиоактивностью. Все химические элементы, начиная с порядкового номера 83, являются радиоактивными.
Виды радиоактивных излучений
1898 г. подвергая радиоактивное излучение действию магнитного поля, Э. Резерфорд выделил два вида лучей: α-лучи — тяжелые положительно заряженные частицы (ядра атомов гелия) и β-лучи — легкие отрицательно заряженные частицы (тождественны электронам).
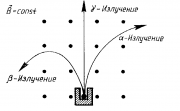
В 1900 г. П. Виллард открыл гамма-лучи — нейтральное излучение, где масса покоя равна нулю (аналогично свойствам света, но  ). После установления Резерфордом структуры атома стало ясно, что радиоактивность представляет собой ядерный процесс.1902 г. Э. Резерфорд и Ф. Содди доказали, что в результате радиоактивного распада происходит превращение атомов одного химического элемента в атомы другого химического элемента, сопровождаемое испусканием различных частиц и сформулировали правила смещения.
). После установления Резерфордом структуры атома стало ясно, что радиоактивность представляет собой ядерный процесс.1902 г. Э. Резерфорд и Ф. Содди доказали, что в результате радиоактивного распада происходит превращение атомов одного химического элемента в атомы другого химического элемента, сопровождаемое испусканием различных частиц и сформулировали правила смещения.
Строение атома
Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий тому назад. Сторонники атомистической теории (Демокрит, Левкипп, Анаксагор, Анаксимандр, Эпикур, Лукреций Кар) рассматривали атом как мельчайшую неделимую частицу и считали, что все многообразие мира есть не что иное, как сочетание неизменных частиц — атомов. Демокрит: существует предел деления атома. Аристотель: делимость вещества бесконечна. Париж, 1626 г.: учение об атоме запрещено под страхом смерти. Сторонниками атомистической теории были М.В. Ломоносов, Ж. Гей-Люссак, Д. Дальтон и др.
Толчком к подробному изучению строения атома послужили:
— открытие рентгеновского излучения (1895 г., В.К. Рентген);
— открытие радиоактивности и новых радиоактивных элементов (1896 г., А. Беккерель, М. и П. Кюри);
— открытие электрона (1896 г., Дж. Дж. Томсон).
Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 г., развил X. Лоренц: электроны входят в состав атома. Опираясь на эти открытия, Дж. Томсон в 1898 г. предложил модель атома в виде положительно заряженного шара радиусом 10 -10 м. в котором плавают электроны, нейтрализующие положительный заряд.
Ядерная модель атома
Экспериментальная проверка модели Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом.
Идея опыта заключалась в изучении рассеяния α-частиц (заряд +2е, масса 6,64 . 10 -27 кг) на атомах. α-частицы были выбраны, т.к. их кинетическая энергия много больше кинетической энергии электронов (β-лучи) и, в отличие от γ-лучей они имеют электрический заряд.
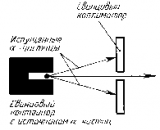
Пучок α-частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Опыты были повторены и на других материалах
Э. Резерфорд и его помощники Г. Гейгер и Э. Марсден обнаружили, что какая-то частьa-частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть отражается от фольги. Но согласно модели атома Томсона эти a-частицы при взаимодействии с атомами фольги отклоняются на малые углы, порядка 2°.
Резерфорд показал, что модель Томсона находится в противоречии с его опытами. Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома:
-
Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома (
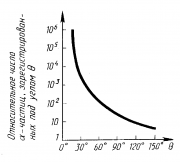
Расчеты показали, что a-частицы, которые взаимодействуют с электронами в веществе, почти не отклоняются.
Только некоторые a-частицы проходят вблизи ядра и испытывают резкие отклонения. Если между зарядами действует кулоновская сила 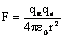 или потенциальная энергия системыa-частица — ядро
или потенциальная энергия системыa-частица — ядро 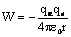 и
и 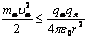 , то α-частица будет отброшена назад.
, то α-частица будет отброшена назад.
При расчете учитывают, что 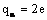 , где e — заряд электрона;
, где e — заряд электрона; 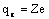 , где Z — зарядовое число, равное количеству электронов в атоме; диаметр ядра 10 -15 — 10 -14 м, атома 10 -10 м.
, где Z — зарядовое число, равное количеству электронов в атоме; диаметр ядра 10 -15 — 10 -14 м, атома 10 -10 м.
Однако предложенная модель строения атома не позволила объяснить устойчивость атома:
— ускоренное движение электрона согласно теории Максвелла сопровождается электромагнитным излучением, поэтому энергия электрона уменьшается, и он движется по спирали, приближаясь к ядру. Казалось бы, электрон должен упасть на ядро (расчет показывает, что это должно произойти за 10 -8 с), так как при движении по спирали уменьшается энергия электрона, в действительности атомы являются устойчивыми системами;
— спектр излучения при этом должен быть непрерывным (должны присутствовать все длины волн). На опыте спектр получается линейчатым;
— нет ответа на вопрос о строении ядра. Если в него входят только положительные частицы, то почему они не отталкиваются?
Понятие атом Строение атома и атомного ядра
Модель атома кислорода:

Заряд ядра равен порядковому номеру химического элемента
Из курса физики вам известно, что вокруг положительного ядра находятся отрицательно заряженные частицы электроны — е — . В электронейтральном атоме число электронов должно быть равно заряду ядра и, следовательно, порядковому номеру элемента. Масса электрона очень мала и принимается равной нулю, таким образом, масса атома сосредоточена в ядре, в котором расположены протоны – p + и нейтроны – n .
Заряд ядра атома = Порядковому номеру (N) = Числу протонов = Число электронов
Число нейтронов = Атомная масса ( Ar ) – Порядковый номер (N)
Задача №1. Определите состав атома бора?
N ( порядковый номер) – 5
Ar ( B ) = 11
e — = Порядковому номеру (N) = 5
p + = Порядковому номеру (N) = 5
n 0 = Атомная масса (Ar) – Порядковый номер (N) = 11 – 5 = 6
Задача №2. Определите состав атома хлора?
Хлор
N ( порядковый номер) – 17
Ar ( Cl ) = 35,5
e — = Порядковому номеру (N) = 17
p + = Порядковому номеру (N) = 17
n 0 = Атомная масса (Ar) – Порядковый номер (N) = 35,5 – 17 = 18,5
Почему в атоме хлора дробное число нейтронов?

Изотопы природного водорода:
Протий: 1 1 H ( e — = 1; p + = 1; n 0 = 1-1 = 0)
Дейтерий: 1 2 Н ( e — = 1; p + = 1; n 0 = 2-1 = 1)
Тритий: 1 3 Н ( e — = 1; p + = 1; n 0 = 3-1 = 2)
Изотопы одного и того же химического элемента имеют разную массу, так как в их атомных ядрах содержится разное количество нейтронов.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ
Химический элемент – это вид атомов с одинаковым зарядом ядра.
В природе химические элементы существуют в виде смесей изотопов. Изотопный состав одного и того же химического элемента выражают в атомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%.
ωат ( 35 С l ) = 0,754 или 75,4%
ωат ( 37 С l ) = 0,246 или 24,6%
Почему в таблице Д. И. Менделеева для химических элементов относительные атомные массы представлены в виде дробных чисел?
В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными.
Ar средняя = ω ат.(1) ∙ Ar (1) + … + ω ат.( n ) ∙ Ar ( n )
Задача : Вычислите относительную атомную массу химического элемента хлора , если известно, что он состоит из двух изотопов: 35 Cl (атомная доля 75,4%) и 37 Cl (24.6%) .
Найти: Ar средняя ( Cl ) = ?
Ar средняя ( Cl ) = 0,754 ∙ 35 + 0,246 ∙ 37 = 35,453
Задания для закрепления
№1. Определите атомный состав изотопов хлора 35 Cl и 37 Сl. Почему изотопы хлора имеют разное массовое число?
№2. Определите относительную атомную массу элемента кремния, если известно, что он состоит из трёх изотопов: 28 Si (атомная доля 92,3%), 29 Si (4,7%), 30 Si (3%).
Понятие атом Строение атома и атомного ядра
Выполнила Трупанова Елена.
микроскопических размеров и массы,наименьшая часть
являющаяся носителем его свойств.
Атом состоит из атомного ядра и электронов.Если число протонов в ядре совпадает с числом электронов,то атом в целом оказывается электрически нейтральным.В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом.
История становления понятия “атом”.
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами.В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является неделимым.
- кусочки материи-Демокрит
- Модель атома Томсона (модель «Пудинг с изюмом»)
- Ранняя планетарная модель атома Нагаоки
- Планетарная модель атома Бора-Резерфорда
Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.
Модель атома Томсона.
Моде́ль То́мсона (иногда называемая «пу́динговая модель а́тома») —
модель атома, предложенная в 1904 году Джозефом Джоном
Томсоном. После открытия им в 1897 году электрона, Томсон
предположил, что отрицательно заряженные «корпускулы»
(так Томсон называл электроны, хотя ещё в 1894 году
Дж. Дж. Стоуни предложил называть «атомы электричества»
электронами) входят в состав атома и предложил модель атома,
в котором в облаке положительного заряда, равного размеру атома,
содержатся маленькие, отрицательно заряженные «корпускулы»,
суммарный электрический заряд которых равен заряду положительно заряженного облака, обеспечивая электронейтральность атомов. «Корпускулы» в этой модели распределены внутри положительно заряженного облака с одинаковой по объёму плотностью заряда, подобно изюминкам в тесте пудинга. Отсюда произошёл термин «пудинговая модель атома» .
Ранняя планетарная модель атома Нагаоки
К 1904 году Нагаока разработал раннюю, ошибочную «планетарную модель» атома («атом типа Сатурна»). Модель была построена на аналогии с расчётами устойчивости колец Сатурна (кольца уравновешены из-за очень большой массы планеты). Модель Нагаоки была неверна, но два следствия из нее оказались пророческими:
-ядро атома действительно очень массивно;
-электроны удерживаются на орбите благодаря электростатическим силам (подобно тому, как кольца Сатурна удерживаются гравитационными силами).
Планетарная модель атома Бора-Резерфорда.
В 1911 году Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Квантово-механическая модель атома.
Современная модель атома является развитием планетарной модели Бора-Резерфорда. Согласно современной модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов . Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода .
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий). Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов. Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны.
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66·10−24 г. Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.[17] Масса атома приблизительно равна произведению массового числа на атомную единицу массы. Самый тяжёлый стабильный изотоп — свинец-208 с массой 207,9766521 а. е. м.
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022·1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь (Ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (Радиус атома). Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин. В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо. Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода.Одна капля воды содержит 2 секстиллиона (2·10 в 21) атомов кислорода, и в два раза больше атомов водорода. Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода.Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.
У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий.
Существуют три основные формы радиоактивного распада:
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.
Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу. К бета-распаду относят и обратный процесс — электронный захват, когда один из протонов атомного ядра захватывает орбитальный электрон и превращается в нейтрон, испуская электронное нейтрино.
Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения.
Понятие атом Строение атома и атомного ядра
Письмо с инструкцией по восстановлению пароля
будет отправлено на вашу почту
- Главная
- 8-Класс
- Химия
- Видеоурок «Состав атомов. Изотопы»
- § 1 Открытие радиоактивности
- § 2 Создание планетарной модели атома
- § 3 Состав атомов
- § 4 Изотопы
- § 5 Краткие итоги урока
В ходе наблюдений и опытов мы познакомились со многими веществами. Мы узнали, что все вещества состоят из связанных между собой атомов.
Атом – мельчайшая частица химического элемента, наименьшая часть простых и сложных веществ.
Способность атомов образовывать разные химические соединения зависит от их состава и строения. Поэтому необходимо изучить атомы, познать их внутреннюю, невидимую простым глазом природу, чтобы объяснить образование и изменения веществ. Важной предпосылкой для изучения состава и строения атома было открытие явления радиоактивности.

В 1896 году французский ученый Антуан Анри Беккерель обнаружил, что атомы химического элемента урана испускают α-излучение наподобие рентгеновского. В 1898 году Мария Склодовская-Кюри получила из урановой руды два новых радиоактивных металла – полоний и радий. Совместно с Пьером Кюри она установила, что атомы этих металлов выделяют такие же лучи, как и уран, но более интенсивно. В 1900 году Пьер Кюри открыл γ-излучение. Уран, полоний и радий были названы радиоактивными элементами, а само явление излучения – радиоактивностью.
Радиоактивность – это свойство атомов некоторых элементов произвольно излучать невидимые глазом частицы, оно обусловлено распадом их атомных ядер, превращением в другие элементы.
Этот распад сопровождается излучением трёх видов:α, β и γ.
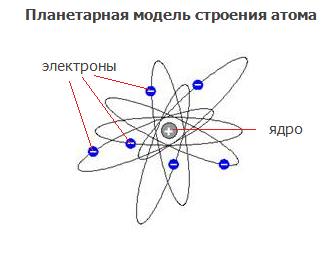
Используя α-излучение (поток ядер гелия, обладающих большой скоростью, имеющих массу 4 и заряд +2) и испытывая его действие на тонкую металлическую фольгу бериллия, английский ученый Эрнест Резерфорд обнаружил, что α-частицы, проходя через нее, отклоняются от первоначального направления движения. Это открытие послужило экспериментальным доказательством существования положительно заряженного ядра атома.
На его основе в 1911 году ученый предсказал наличие в ядре атома положительно заряженной частицы – протона и создал планетарную модель атома.
Согласно планетарной модели атом состоит изнесущего положительный заряд ядра и движущихся вокруг него отрицательно заряженных частиц – электронов.

В 1932 году Джеймс Чедвик открыл нейтрон, а еще позднее было выявлено огромное число разнообразных микрочастиц, входящих в состав протона.
В современной науке основными элементарными частицами атома признаны протон, нейтрон, электрон. Остановимся подробнее на составе атома и характеристике этих частиц.
Атом состоит из ядра и электронов.Ядро – это часть атома, состоящая из протонов и нейтронов и имеющая положительный заряд. Масса атома определяется массой его протонов и нейтронов.
По своей массе протоны и нейтроны почти одинаковы: 1,673 × 10-24 г и 1,675 × 10-24г. Пользоваться массой таких маленьких частиц в граммах очень неудобно, поэтому введено понятие относительной атомной массы. Сравнивая массы протона и нейтрона с одной углеродной единицей, которая равна 1,661 × 10-24г, получаем простые целые числа – масса протона равна 1, масса нейтрона равна 1.
Протон имеет положительный заряд, равный +1, а нейтрон заряда не имеет.
Электрон имеет наименьший заряд (1,6 × 10-19Кл), который условно принят за единицу,
т.е. – 1. Массой электронов по сравнению с массой ядра можно практически пренебречь (масса протона более чем в 1800 раз превышает массу электрона). Обобщим вышесказанное в виде следующих определений.
Протоны – это элементарные частицы с массой, приблизительно равной 1, и зарядом +1.
Нейтроны – это электронейтральные (незаряженные) частицы ядра атома с массой, равной 1.
Электроны – это отрицательно заряженные частицы атома, расположенные вокруг ядра атома. Они образуют электронную оболочку атома.
Разновидности атомных ядер с определённым числом протонов и нейтронов называются нуклидами.
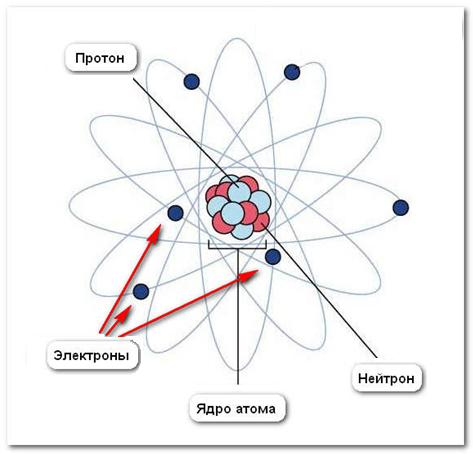
Согласно современной теории ядра, протоны и нейтроны, входящие в состав ядра, связаны между собой чрезвычайно большими ядерными силами. Ядро по своим размерам весьма компактно. Оно в 100 000 раз меньше самого атома, но отличается большой плотностью. В нём сосредоточена почти вся масса атома.
Составляющие атом частицы обусловливают его важнейшие характеристики. С некоторыми из них мы уже знакомы (валентность, масса и другие).
Заряд ядра – важнейшая характеристика атома и соответствующего ему химического элемента, лежащая в основе его современного определения. Положительный заряд ядра создают его протоны: заряд ядра равен числу протонов в нем. Порядковый (атомный) номер элемента в периодической системе равен заряду ядра его атомов и обозначается буквой Z. Следовательно, заряд ядра является также важнейшей характеристикой химического элемента.
химический элемент – это вид атомов с одинаковым зарядом ядра.
Другой характеристикой атома, зависимой от протонов и нейтронов ядра, является масса ядра. Она обозначается буквой А и называется массовым числом.
Массовое число – это сумма числа протонов и нейтронов в ядре атома.
Обе характеристики используются для индексации атома: они ставятся слева от символа элемента, где А – верхний индекс, а Z – нижний индекс, например: 126С.
Протоны и нейтроны определяют количественные характеристики атомов. От электронов атома зависят его качественные характеристики – способность объединяться с другими атомами, химические свойства.
Обратимся к периодической системе химических элементов Д. И. Менделеева.
Мы видим, что числа, выражающие атомные массы элементов, имеют дробные значения, а при закономерном линейном увеличении атомных масс химических элементов имеет место некоторое «нарушение» закономерности.
Возникает вопрос, почему в парах элементов аргон – калий, кобальт – никель, теллур – йод впереди стоящий элемент имеет большую атомную массу, чем последующий, почему атомные массы элементов обозначены дробными числами, если массы протонов и нейтронов приняты за 1, а массой электронов как ничтожной можно пренебречь? Какова причина кажущихся «нарушений»?
Ответы дают экспериментальные и теоретические исследования состава ядер и масс атомов различными методами. Они показали, что в ядрах атомов одного и того же элемента всегда имеется одинаковое число протонов, но может содержаться разное число нейтронов. Такие атомы отличаются друг от друга разным массовым числом и некоторыми свойствами (например, разной скоростью диффузии). Так, например, в составе элемента углерода имеются атомы с числом нейтронов 6, 7, 8. Но все они относятся к одному элементу – углероду, поскольку заряд ядра у них одинаков: +6.
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разную атомную массу, называются изотопами.
Термин происходит от греческого isos – «равный», topos — «место», т. е. занимающие одно и то же место в периодической системе.

В большинстве случаев в природе каждый элемент представляет собой совокупность разных его изотопов. Содержание каждого изотопа в элементе обычно выражают в процентах. Например, природный кислород состоит из трёх изотопов: 16О, его изотопное содержание 99,76%, 17О – его 0,04%, и 18О – его 0,2%.
Относительная атомная масса химического элемента равна среднему значению масс всех его природных изотопов с учётом их распространённости. В качестве стандарта для определения относительной атомной массы принимается 1/12 массы изотопа атома углерода 12С.
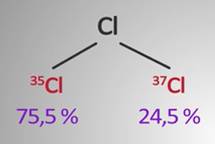
Например, хлор имеет два изотопа: 35С1 – его содержание составляет 75,5 %, и 37С1 – его 24,5 %.
Относительная атомная масса хлора равна 35 × 0,755 + 37 × 0,245 = 35,459 = 35,5.
Эту же величину мы видим в периодической таблице.
Явление изотопии позволяет объяснить причину некоторых «нарушений» в последовательном увеличении значений атомных масс элементов в уже упоминавшихся ранее парах: аргон – калий, кобальт – никель, теллур – йод.
Содержание самого легкого изотопа калия 39К составляет 93 %, это выше, чем более содержание тяжелых изотопов 40К и 41К. Поэтому среднее значение относительной молекулярной массы калия равно 39,102. У аргона, наоборот, преобладает содержание тяжёлого изотопа 40Ar, его около 99 %. Относительная атомная масса аргона составляет 39,948. Отсюда у аргона, элемента с порядковым номером 18, относительная атомная масса больше, чем у элемента с порядковым номером 19. Подобным образом объясняются и другие отклонения в изменении масс элементов в периодической системе.
Изотопы известны для всех химических элементов. Наибольшее число изотопов имеют элементы с порядковым номером 2, от 40 до 56.
Теория строения ядра и явление изотопии позволяют уточнить понятие об относительной атомной массе элемента, углубить знания об элементе и дать ему более современные определения. Химический элемент – это вид атомов с одинаковым зарядом ядра. Химический элемент – это совокупность его изотопов.
Урок 1. Схема строения атомов
В уроке 1 «Схема строения атомов» из курса «Химия для чайников» рассмотрим основы строение атома и состав атомного ядра; выясним, что такое атомная единица массы, порядковый номер атома и атомная масса элемента. Обязательно просмотрите основные понятия и определения к разделу «Атомы, молекулы и ионы», чтобы лучше воспринимать суть изложенного материала в данной главе.

Основы строения атома
Пока не будем говорить, кто и когда узнал о существовании атома, а сразу перейдем к основам его строения: Атом — это мельчайшая частица вещества, которая состоит из ядра (заряд «+»), окруженного электронами (заряд «–»).
Электроны расположены на электронных оболочках атома: чем больше заряд ядра, тем больше электронов и электронных оболочек. Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Состав ядра атома
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
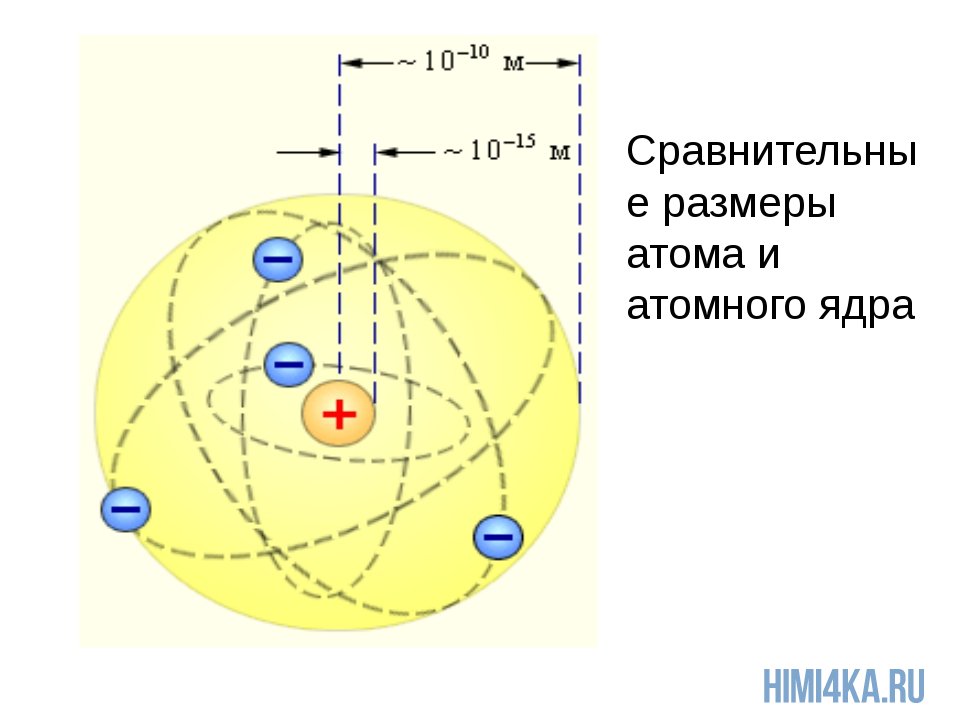
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели. Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона
1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала , поэтому в данном случае с ней даже не считаются.

Перевод граммов в атомные единицы массы выглядит так: 1 гр = 6,022×10 23 а.е.м и наоборот 1 а.е.м. = 1,66×10 -24 г. Число 6,022×10 23 носит название — число Авогадро N (позже мы рассмотрим способ ее вычисления). Ниже изображена сравнительная таблица зарядов и масс элементарных частиц:
| Название | Заряд, Кл | Масса, гр | Масса, а.е.м. |
| Протон | +1,6·10 -19 | 1,67·10 -24 | 1,00728 |
| Нейтрон | 1,67·10 -24 | 1,00866 | |
| Электрон | -1,6·10 -19 | 9,10·10 -28 | 0,00055 |
Порядковый номер атома и атомная масса элемента
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
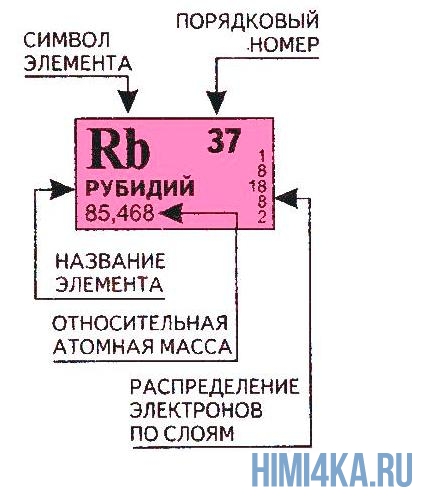
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т.д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Строение атома

Строение атома
Уже древнегреческие ученые догадывались о существовании мельчайших химически частиц, из которых состоит любой предмет и организм. И если в XVII-XVIII вв. химики были уверены, что атом неделимая элементарная частица, то на рубеже XIX-XX вв., опытным путем удалось доказать, что атом не является неделимым.
Атом, будучи микроскопической частицей вещества, состоит из ядра и электронов. Ядро в 10000 раз меньше атома, однако практически вся его масса сосредоточена именно в ядре. Главной характеристикой атомного ядра, является то, что он имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны).
Атом любого элемента можно обозначить электронной формулой и электронно графической формулой:
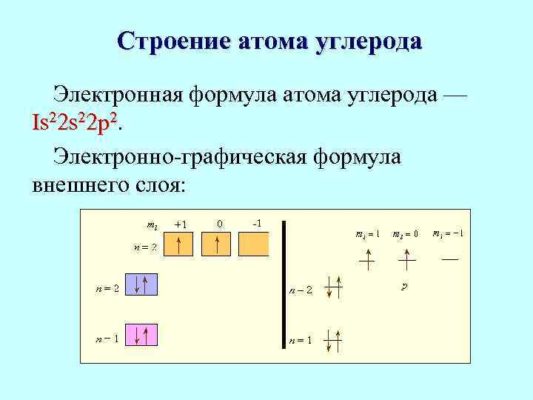
Рис. 1. Электронно-графическая формула атома.
Единственным химическим элементом из периодической системы, в ядре которого не содержатся нейтроны, является легкий водород (протий).
Электрон является отрицательно заряженной частицей. Электронная оболочка состоит из движущихся вокруг ядра электронов. Электроны имеют свойства притягиваться к ядру, а между друг друг на них оказывает влияние кулоновское взаимодействие. Чтобы преодолеть притяжения ядра, электроны должны получать энергию от внешнего источника. Чем дальше электрон находится от ядра, тем меньше энергии для этого необходимо.
Модели атомов
На протяжении долго времени ученые стремились познать природу атома. На раннем этапе большой вклад внес древнегреческий философ Демокрит. Хотя сейчас его теория и кажется нам банальной и слишком простой, в тот период, когда представления об элементарных частицах только начинало зарождаться, его теория о кусочках материи воспринималась совершенно серьезно. Демокрит считал, что свойства любого вещества зависят от формы, массы и других характеристик атомов. Так, например, у огня, полагал он, острые атомы – поэтому огонь обжигает; у воды атомы гладкие, поэтому она способна течь; у твердых предметов, по его представлению, атомы были шереховатые.
Демокрит считал, что из атомов состоит абсолютно все, даже душа человека.
В 1904 году Дж. Дж. Томсон предложил свою модель атома. Основные положения теории сводились к тому, что атом представлялся положительно заряженным телом, внутри которого находились электроны с отрицательным зарядом. Позже эта теория была опровергнута Э. Резерфордом.

Рис. 2. Модель атома Томсона.
Также в 1904 году японским физиком Х. Нагаока была предложена ранняя планетарная модель атома по аналогии с планетой Сатурн. Электроны по этой теории объединены в кольца и вращаются вокруг положительно заряженного ядра. Эта теория оказалась ошибочной.
В 1911 году Э. Резерфорд, проделав ряд опытов, сделал выводы, что атом по своему строению похож на планетную систему. Ведь электроны, словно планеты, движутся по орбитам вокруг тяжелого положительно заряженного ядра. Однако это описание противоречило классической электродинамике. Тогда датский физик Нильс Бор в 1913 году ввел постулаты, суть которых заключалась в том, что электрон, находясь в некоторых специальных состояниях, не излучает энергию. Таким образом, постулаты бора показали, что для атомов классическая механика неприменима. Планетарная модель, описанная Резерфордом и дополненная Бором, получила название – планетарная модель Бора-Резерфорда.

Рис. 3. Планетарная модель Бора-Резерфорда.
Дальнейшее изучение атома привело к созданию такого раздела, как квантовая механика, с помощью которого объяснялись многие научные факты. Современные представления об атоме развились из планетарной модели Бора-Резерфорда.
Что мы узнали?
В данной статье по химии (8 класс) рассказывается кратко и понятно о строении атома. На протяжении многих веков ученые разных стран изучали мельчайшие частицы вещества. Появлялись разные теории, модели и разные формулы строения атома. Современные представления об атоме основываются на модели Бора-Резерфорда, по которой атом состоит из ядра и электронного облака, в котором электроны движутся вокруг ядра.



